中国临床研究服务业
药物研发流程
过程中涉及研发和对候选药物进行测试,以证明其安全性和有效性,从而获得监管机构批准进入市场。 此过程通常是昂贵、复杂、存在风险和耗时的,整个过程通常包括四个阶段,分别是(i)发现、(ii)临床前、(iii)临床和注册,包括I至IV期临床试验和(iv)制造。
研发外判服务
药品研发过程的复杂、存在风险、耗时和昂贵的性质对药品研发外判服务产生了巨大的需求。 此类服务由两种类型的药品研发外判服务商提供,分别是CROs(合同研究组织)和CDMOs(合同开发制造组织)。 CROs为制药公司提供各种研发的服务,包括研发、临床前以及临床和注册阶段,而CDMOs在制造阶段主要从事CMC(化学、制造和控制)的服务。
随著制药行业不断发展,CROs在需要大量资本、复杂、存在风险和耗时的制药研发过程中发挥著越来越重要的作用。 CROs提供全面的研发解决方案,涵盖(i)发现阶段、(ii)临床前阶段和(iii)临床阶段,包括I至IV期临床试验。
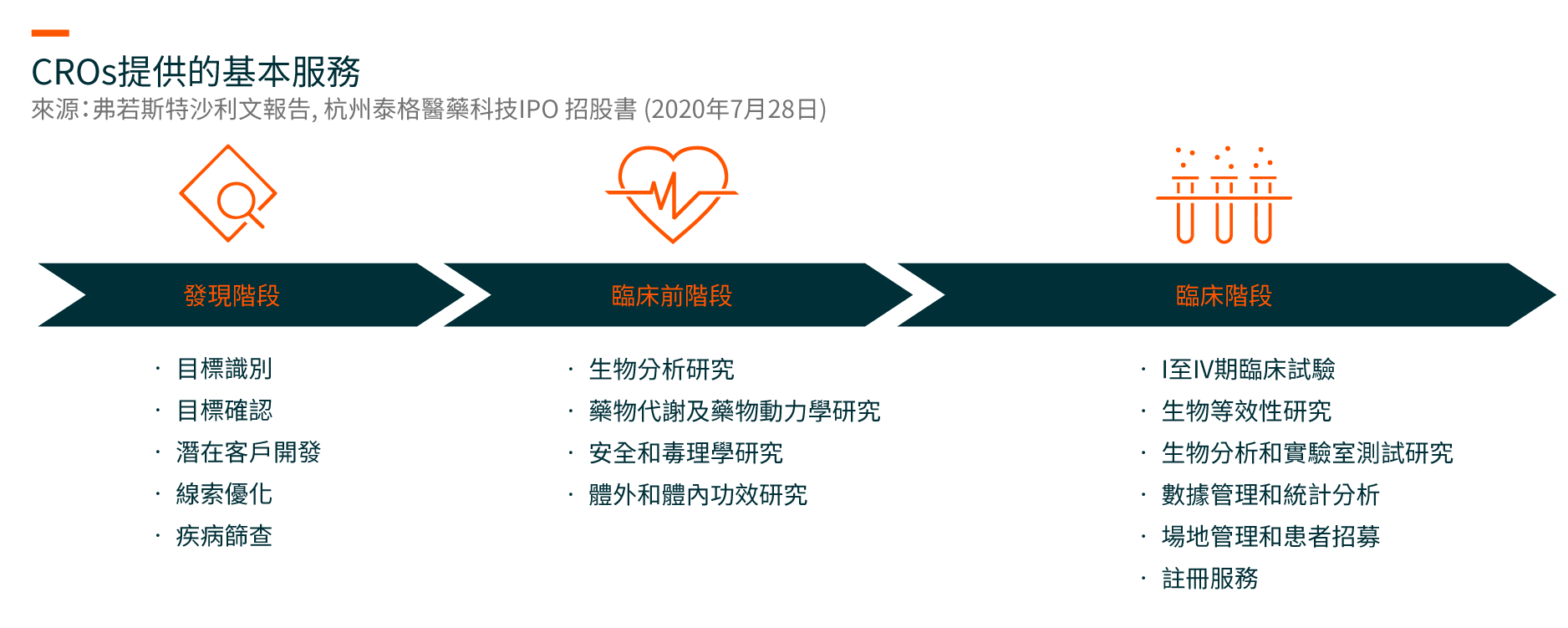
制药公司依靠具有强大项目管理和科学专业知识,专业经验丰富的人才库,创新技术和丰富监管经验的CROs来管理复杂的项目,以降低研发风险和成本,并加快开发安全有效药物。
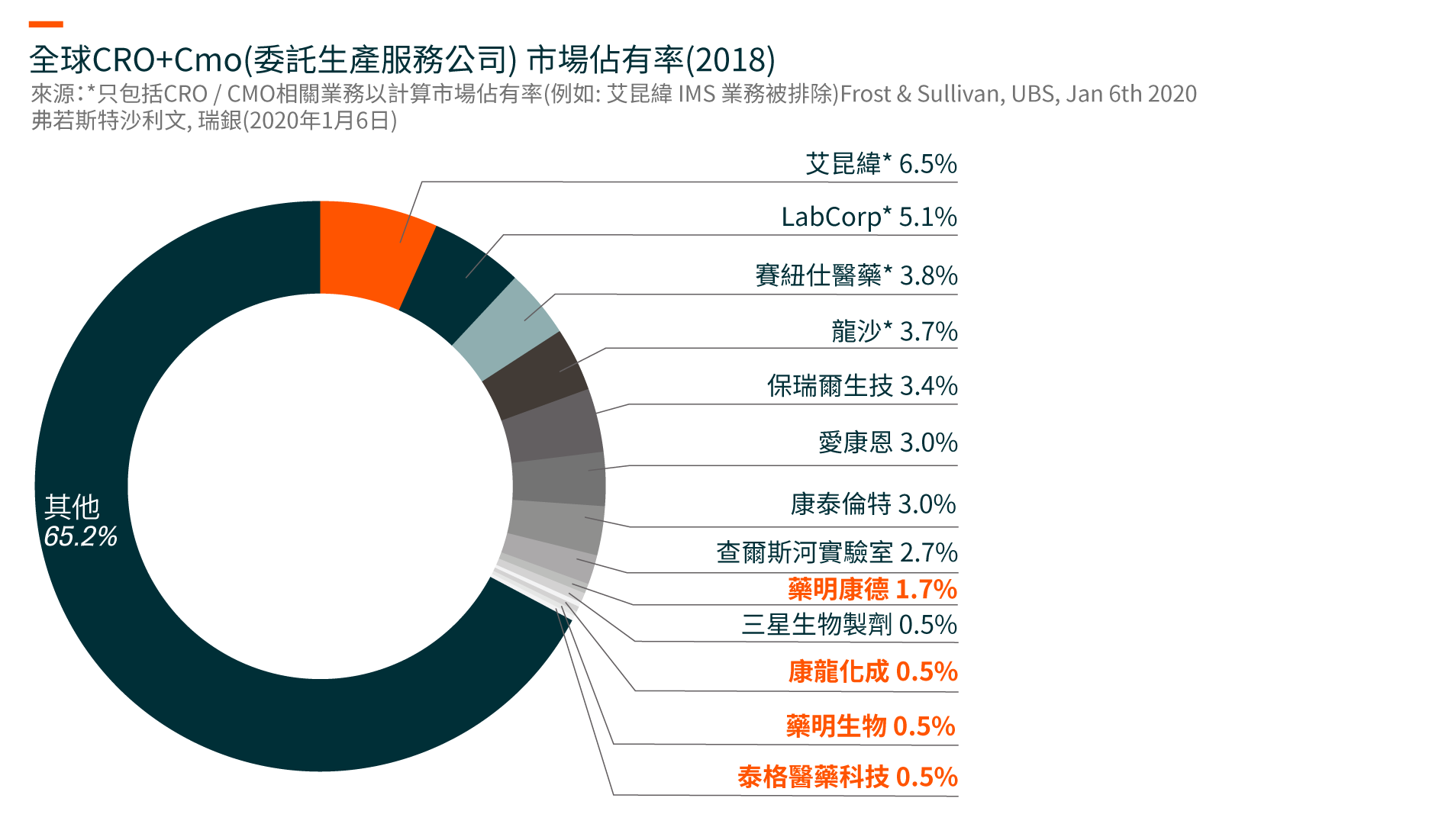
推动全球以及中国医药研发服务市场增长的关键因素包括:
- 增加研发支出,推动CROs的增长。
- 研发过程的复杂性越来越高–这导致许多制药公司将更多的研发活动外判给具有先进技术及经验丰富的CROs。
- 节省成本–面对新药开发竞争日益激烈和研发收益降低的情况下,CROs帮助他们高效,专业地管理研发活动,同时降低成本和风险。
- 新兴的生物技术公司–尤其是在中国涌现了许多生物技术公司,由于内部资源和能力有限,许多新兴生物技术公司都严重依赖第三方服务提供商来指导其复杂的研发项目,从而产生了对CRO服务的额外需求。
- 中国政府的优惠政策–中国政府已对监管审查和批准制度进行了改革,并涵盖了整个中国医药市场的价值链,从临床试验、监管提交、制造到医疗保险都有覆盖。 改革为专门从事创新药物开发的CROs带来了更多的商机,当中中国发布了各种有利的政策来鼓励药品CRO市场的发展,例如在2017年发布的《国际外包服务业发展第十三个五年计划》。
按地区划分的市场规模
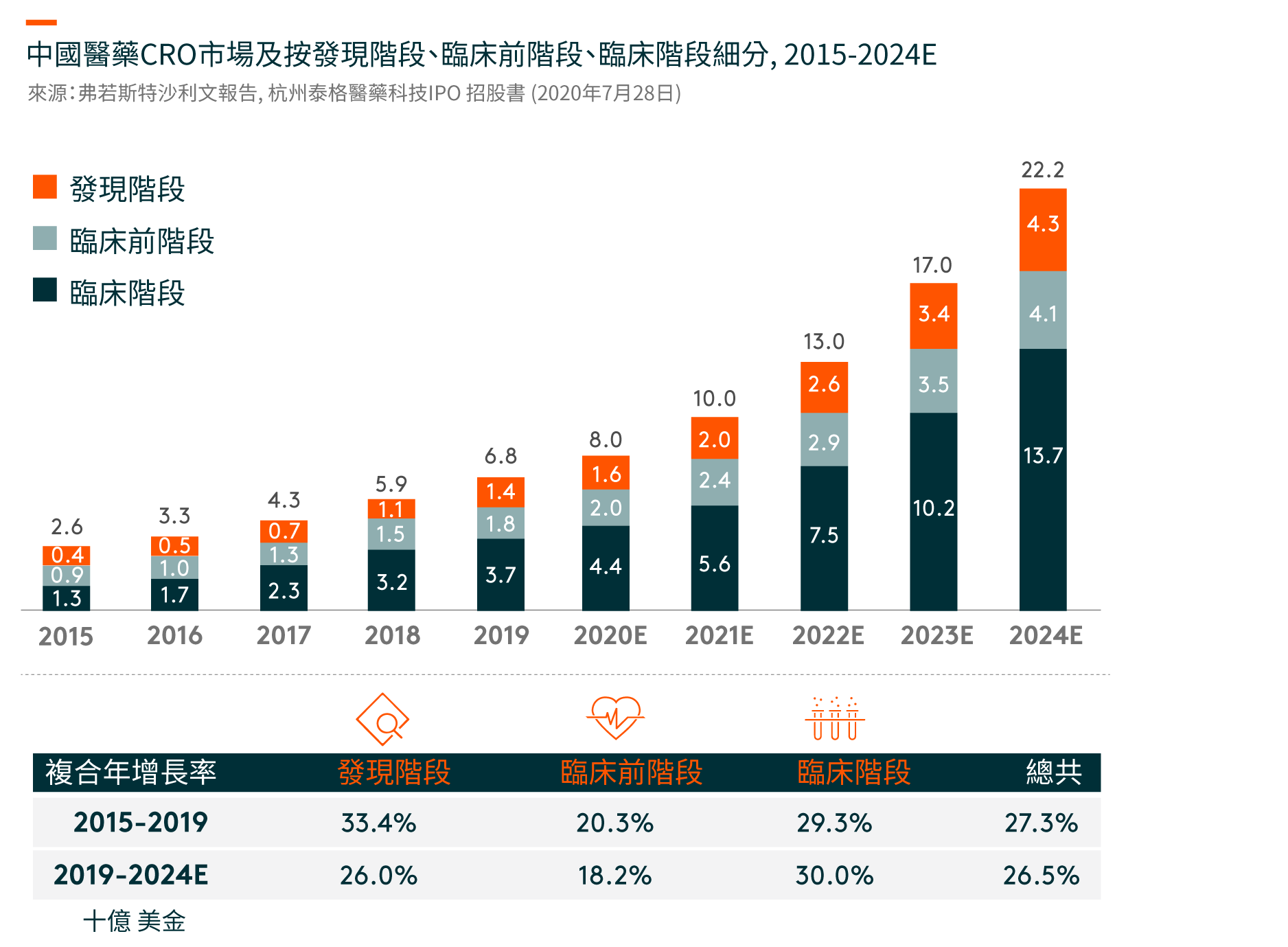
美国是最大的临床CRO市场,在2019年将达到209亿美元,并预计在2019-24年期间将以8%的复合年增长率(CAGR)增长。 尽管中国的临床CRO市场尚处于早期阶段,但预计将从2019年的37亿美元迅速增长到2024年的137亿美元,复合年增长率为30%。
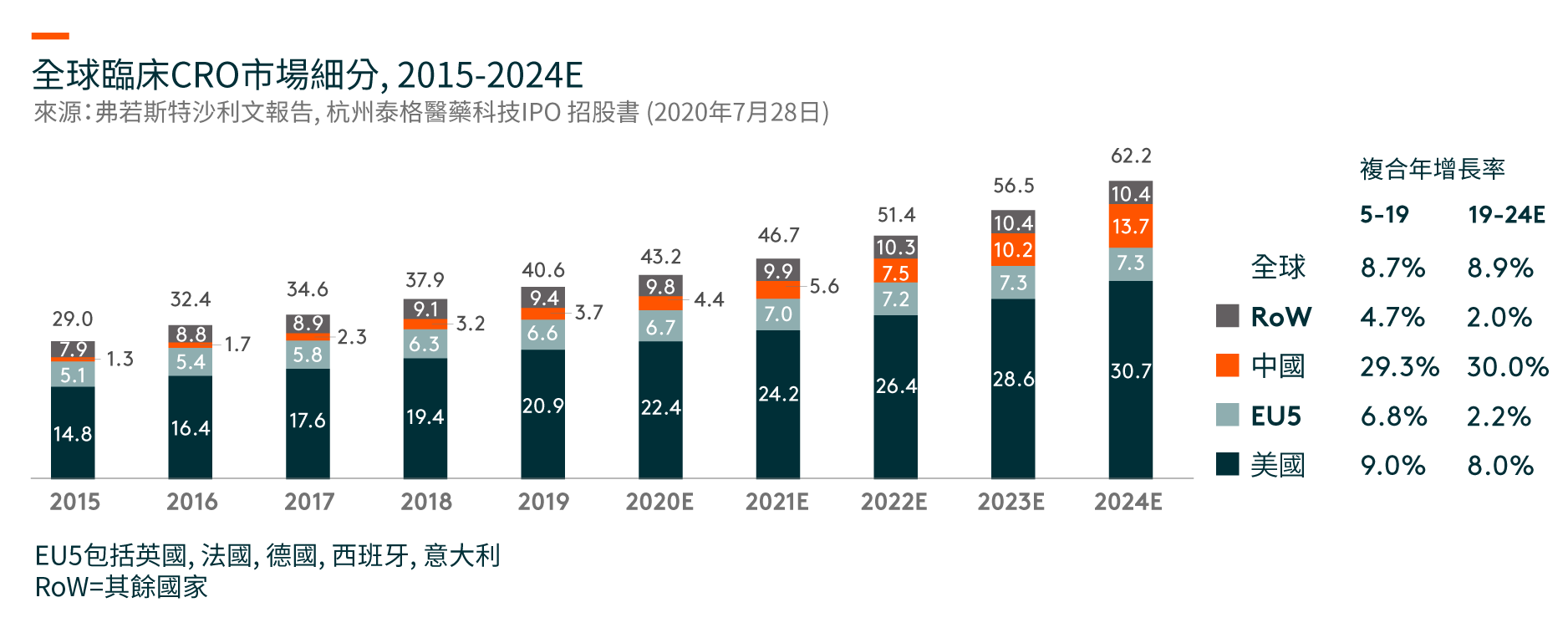
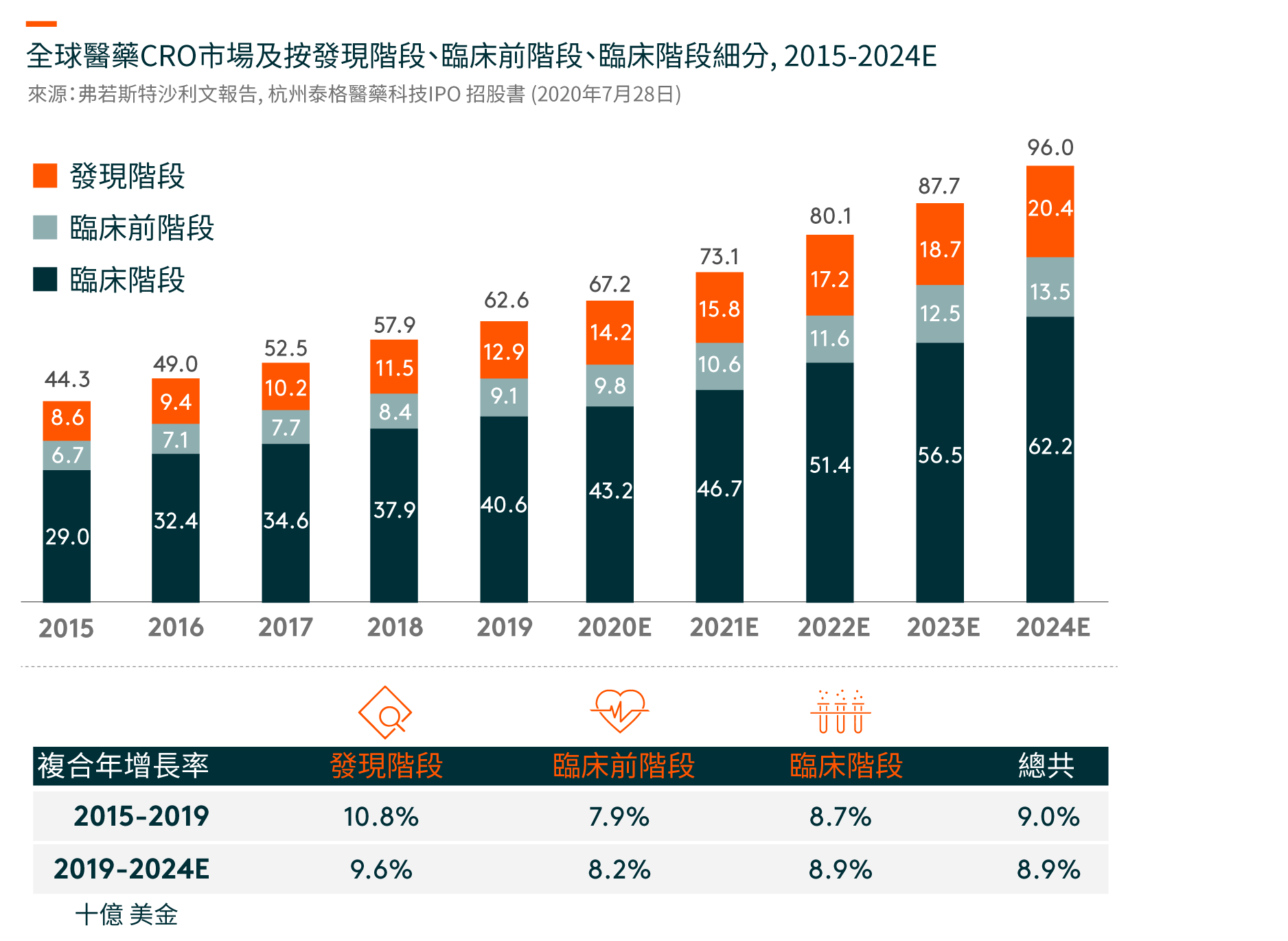
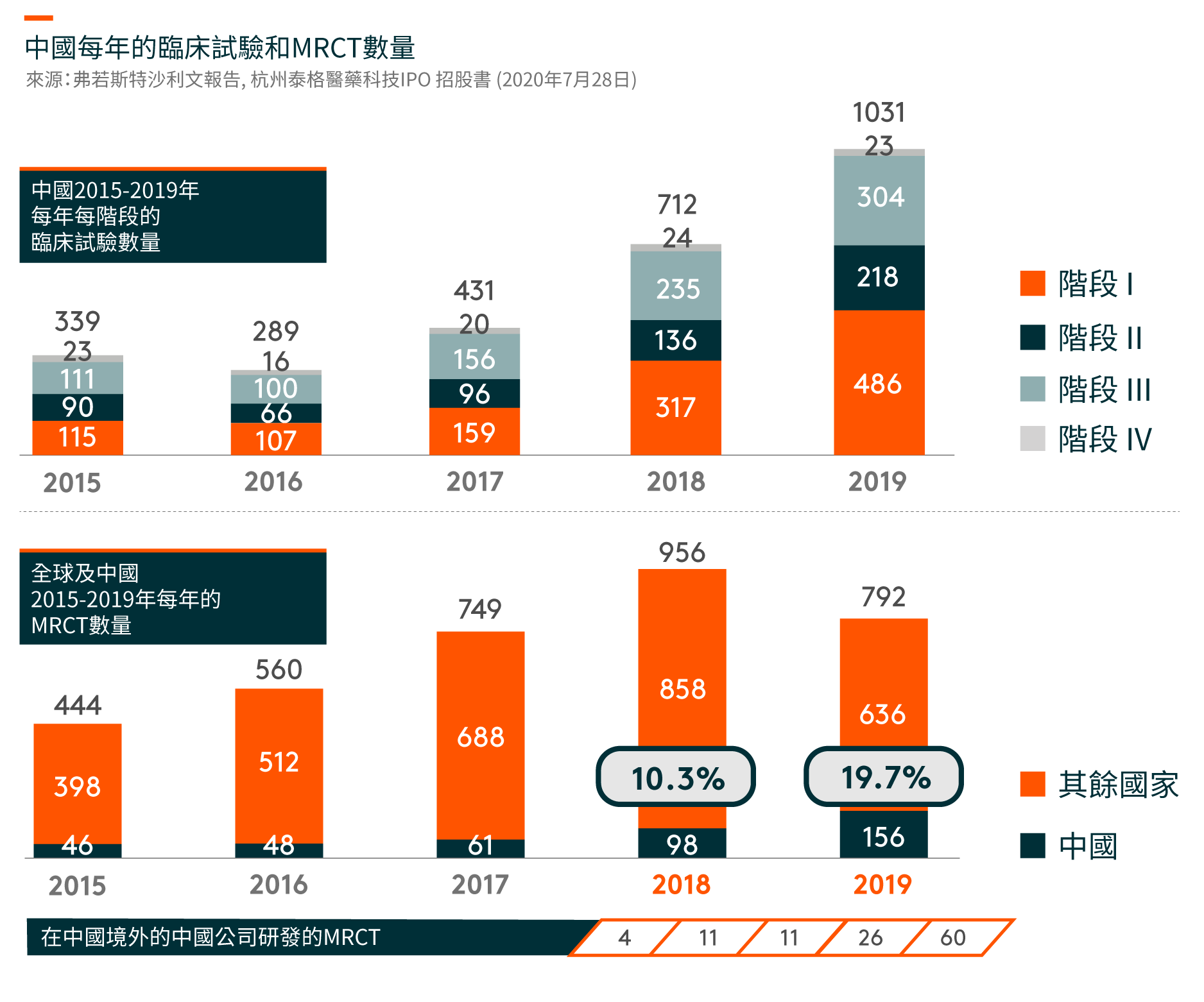
在中国,临床试验的数量从2015年的339项增加到2019年的1,031项。随著药物研发的不断全球化和中国成为全球药物研发行业不可或缺的一部分,在中国进行多区域临床试验(MRCTs)的数量也有所增加。自中国于2017年加入ICH(人类使用药品注册的技术要求国际会议)(一个旨在统一不同国家对药品开发和注册的技术和法规要求的组织),中国一直在更新和遵循适用于成熟市场药品临床开发的法规,海外产生的临床数据亦可以用作补充数据以支持中国的注册申请。另一方面,跨国制药公司在中国进行临床试验的MRCTs越来越多,从以支持其向NMPA(国家药品监督管理局,前称中国食品药品监督管理局)的注册申请。
相关ETF
Global X中国生物科技ETF 使投资者能够投资于对中国生物技术发展至关重要的公司,以获得高增长潜力。。
其他特征
- 集中投资: 该基金针对新兴主题和行业进行针对性的投资。
- ETF的投资便利:透过一次买卖交易,该基金可以投资于数十家以中国生物科技为主题的公司。
请点击此处以了解更多有关Global X中国生物科技ETF 的资料。



